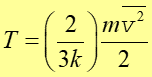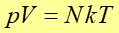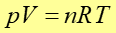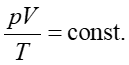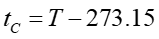15.2 Temperatura, równanie stanu gazu doskonałego
Zerowa zasada termodynamiki
Potocznie temperaturę rozumiemy jako miarę ciepłoty układu. Za pomocą dotyku, możemy np. stwierdzić, które z dwóch ciał jest cieplejsze. Mówimy o nim, że ma wyższą temperaturę. Możemy również stwierdzić, że gdy dwa ciała o różnych temperaturach zetkniemy ze sobą (i odizolujemy od innych) to po dostatecznie długim czasie ich temperatury wyrównają się. Mówimy wtedy, że te ciała są w równowadze termicznej ze sobą. Formułujemy teraz postulat nazywany zerowa zasadą termodynamiki.
|
Prawo, zasada, twierdzenie Jeżeli ciała 1 i 3 są w równowadze termicznej, a także ciała 2 i 3 są w równowadze termicznej to ciała 1 i 2 są w tej samej równowadze termicznej. |
Jako kryterium równowagi cieplnej między ciałami wprowadzamy pojęcie temperatury
![]() .
Umawiamy się, że układom fizycznym, które mogą być jednocześnie ze
sobą w stanie równowagi cieplnej, przypisujemy tę samą temperaturę.
.
Umawiamy się, że układom fizycznym, które mogą być jednocześnie ze
sobą w stanie równowagi cieplnej, przypisujemy tę samą temperaturę.
Kinetyczna interpretacja temperatury
Teraz gdy zapoznaliśmy się z pojęciem temperatury poznamy jej definicję na gruncie teorii kinetycznej, czyli przy podejściu mikroskopowym.
|
Definicja Temperaturę bezwzględną definiujmy jako wielkość wprost proporcjonalną do średniej energii kinetycznej cząsteczek. |
|
(15.13) |
Czynnik (2/3k) jest współczynnikiem proporcjonalności. Wartość stałej k, zwanej stałą Boltzmana, wynosi k = 1.38·10-23 J/K. Z tej definicji wynika, że średnie energie kinetyczne ruchu postępowego (na cząsteczkę) dla dwu kontaktujących się gazów są równe.
Równanie stanu gazu doskonałego
Jeżeli obliczymy ![]() z zależności (15.13) i podstawimy do
równania (15.10)
to otrzymamy równanie stanu gazu doskonałego w postaci
z zależności (15.13) i podstawimy do
równania (15.10)
to otrzymamy równanie stanu gazu doskonałego w postaci
|
(15.14) |
Ponieważ przy opisie własności gazów wygodnie jest posługiwać się liczbą moli n to równanie stanu gazu często przedstawia się w postaci
|
(15.15) |
gdzie stała R = 8.314·J/mol K jest uniwersalną stałą gazową związaną ze stałą Boltzmana i liczbą Avogadra NAv relacją R = kNAv. Stała Avogadra NAv = 6.023·1023 1/mol, określa liczbę cząsteczek w jednym molu. Przypomnijmy, że mol jest ilością materii układu zawierającego liczbę cząsteczek równą liczbie atomów zawartych w 0.012 kg węgla 12C (równą NAv).
Równanie stanu gazu doskonałego zostało sformułowane w XIX w. przez Clapeyrona na podstawie trzech praw empirycznych odkrytych wcześniej przez innych badaczy:
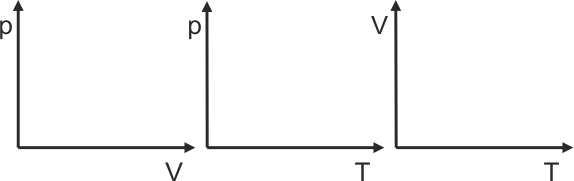
- Prawo Boyle'a-Mariotte'a stwierdza, że w stałej temperaturze iloczyn ciśnienia i objętości danej masy gazu jest stały pV = const.
- Prawo Charlesa mówi, że przy stałej objętości gazu stosunek ciśnienia i temperatury danej masy gazu jest stały p/T = const.
- Prawo Gay-Lussaca stwierdza, że dla stałego ciśnienia stosunek objętości do temperatury danej masy gazu jest stały V/T = const.
|
Ćwiczenie Spróbuj przedstawić graficznie te trzy zależności wykreślając je w różnych układach współrzędnych zamieszczonych poniżej. Sprawdź obliczenia i wynik. |
Clapeyron podsumował te wyniki podając zależność
|
(15.16) |
zgodną z równaniem stanu gazu doskonałego (15.15).
Pomiar temperatury, skale temperatur
Żeby wyznaczyć temperaturę na podstawie definicji (15.13)
musielibyśmy wyznaczyć energię kinetyczną cząsteczek gazu co jest bardzo trudne. Ale możemy się posłużyć równaniem stanu gazu doskonałego
(15.15). Łatwo bowiem jest zmierzyć iloczyn pV na przykład dla gazu pod stałym ciśnieniem
lub przy stałej objętości. Termometr gazowy służył przez wiele lat
jako wzorzec temperatury. Za jego pomocą określono doświadczalnie punkty
odniesienia, takie jak na przykład punkt wrzenia wody, dla praktycznych pomiarów
temperatur. W praktyce w powszechnym użyciu jest skala
Celsjusza ![]() . W tej
skali temperatura równowagi wody i lodu wynosi 0° C, a temperatura równowagi
wody i pary wodnej wynosi 100° C. Natomiast w fizyce stosujemy bezwzględną
termodynamiczną skalę temperatur
. W tej
skali temperatura równowagi wody i lodu wynosi 0° C, a temperatura równowagi
wody i pary wodnej wynosi 100° C. Natomiast w fizyce stosujemy bezwzględną
termodynamiczną skalę temperatur ![]() nazywaną skalą Kelvina
nazywaną skalą Kelvina ![]() .
.
|
Jednostki Jednostką temperatury bezwzględnej jest kelwin (K). Ponieważ w obu skalach Kelvina i Celsjusza różnica pomiędzy temperaturą zamarzania i wrzenia wody wynosi 100 stopni więc wielkość stopnia jest taka sama w obu skalach. |
Między temperaturą w skali Celsjusza tC a temperaturą w skali bezwzględnej T zachodzi związek
|
(15.17) |


 Ciśnienie gazu doskonałego
Ciśnienie gazu doskonałego