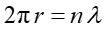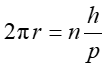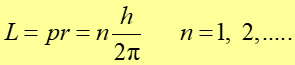34.2 Struktura atomu i fale materii
Teoria sformułowana przez Bohra pozwoliła na wyjaśnienie własności widma atomu wodoru, a przede wszystkim stabilnej struktury atomu. Jednak nie podawała uzasadnienia postulatów, na których się opierała, zwłaszcza reguły kwantowania momentu pędu.
Taką fizyczną interpretację reguł kwantowania Bohra zaproponował de Broglie
przyjmując, że elektron krążący wokół jądra po orbicie kołowej ze stałą prędkością jest reprezentowany przez pewną falę
materii - falę elektronową ![]() .
.
Ta fala, tak jak elektron, przebiega wielokrotnie wzdłuż orbity kołowej, przy czym w każdym kolejnym okresie przebieg ulega dokładnemu powtórzeniu, to znaczy fala jest zgodna w fazie z falami z poprzednich obiegów. W przeciwnym razie powstająca fala wypadkowa miała by natężenie równe zeru.
Ten warunek zgodności faz oznacza, że orbita musi na swym obwodzie mieścić całkowitą liczbę długości fal de Broglie'a
|
(34.4) |
Co w połączeniu z postulatem de Broglie'a prowadzi do wyrażenia
|
(34.5) |
Stąd moment pędu elektronu
|
(34.6) |
Otrzymaliśmy warunek Bohra kwantyzacji momentu pędu, który jest teraz konsekwencją przyjęcia założenia, że elektron jest reprezentowany przez odpowiednią falę materii.
Na rysunku 34.2 przedstawione są fale materii związaną z elektronem poruszającym się po orbicie o promieniu r. Długość fali de Broglie’a została dobrana tak, aby orbita o promieniu r zawierała całkowitą liczbę n fal materii.
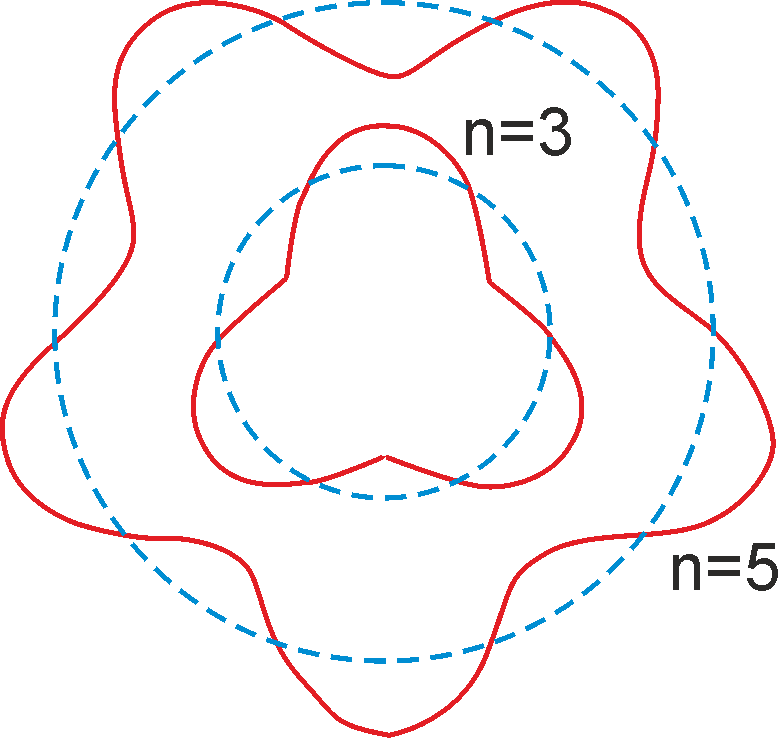
Rys. 34.2. Ilustracja związanych z elektronem fal materii na orbitach Bohra
Przedstawiony powyżej obraz sugeruje powstawanie stojących fal materii.
Mamy do czynienia z sytuacją, w której ruch fal jest ograniczony przez nałożenie pewnych warunków fizycznych (34.4), analogicznie jak dla drgań struny zamocowanej na obu końcach. Przypomnijmy sobie, że mamy wtedy do czynienia z falę stojącą (a nie bieżącą), a co ważniejsze w strunie mogą występować tylko pewne długości fal. Mamy więc do czynienia z kwantyzacją długości fal wynikającą z ograniczeń nałożonych na falę.
Co więcej fale stojące nie przenoszą energii (nie może ona płynąc przez węzły, jest na stałe zmagazynowana w poszczególnych punktach przestrzeni); elektron krążący po orbicie nie emituje promieniowania elektromagnetycznego, jest w stanie stacjonarnym.
Postulat de Broglie'a wiążący elektron ze stojącą falą materii przyniósł zadawalające uzasadnienie reguł kwantowania Bohra i stworzył fundament współczesnej teorii opisu stanów atomowych.
Sam jednak nie był wystarczający, bo miedzy innymi nie dawał informacji o sposobie
rozchodzenia się fal materii. Nie odpowiadał na pytanie jaką postać może mieć funkcja opisująca fale materii - funkcja
falowa ![]() , jak ją
wyznaczyć oraz jaka jest jej interpretacja.
, jak ją
wyznaczyć oraz jaka jest jej interpretacja.
Problem ten został wyjaśniony przez Heisenberga i Schrödingera, którzy zaproponowali nowy sposób opisu świata mikrocząstek - mechanikę kwantową.


 Fale materii
Fale materii