Kiedy pierwiastek lub związek chemiczny, będący w stanie gazowym lub ciekłym, zostanie dostatecznie ochłodzony to krzepnie czyli przechodzi do stanu stałego.
Ciała stałe dzielimy na kryształy, polikryształy
i ciała bezpostaciowe ![]() .
Jak już mówiliśmy w paragrafie 30.5 atomy w krysztale ułożone są w
powtarzający się regularny wzór zwany siecią krystaliczną (na
rysunku 37.1 pokazane jest przykładowo rozmieszczenie atomów w krysztale NaCl).
.
Jak już mówiliśmy w paragrafie 30.5 atomy w krysztale ułożone są w
powtarzający się regularny wzór zwany siecią krystaliczną (na
rysunku 37.1 pokazane jest przykładowo rozmieszczenie atomów w krysztale NaCl).
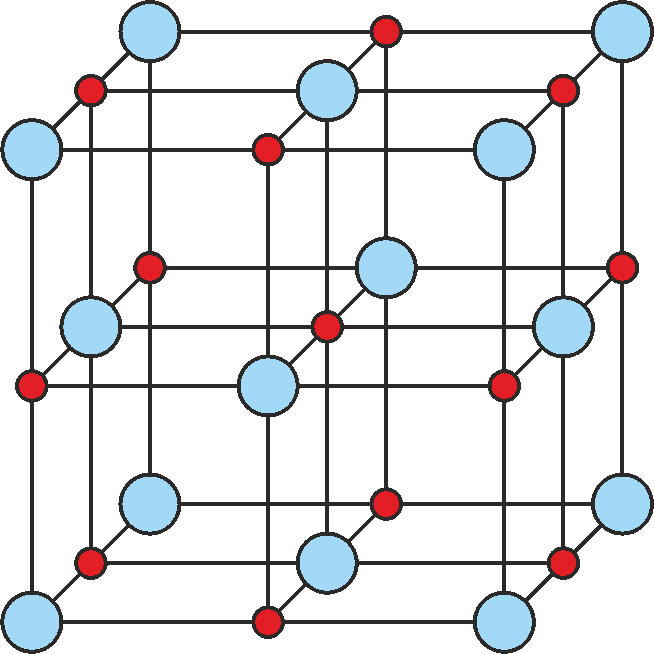
Rys. 37.1. Rozmieszczenie jonów w komórce elementarnej NaCl
Wiele ciał stałych nie posiada jednolitej struktury krystalicznej dlatego, że są zbudowane z bardzo wielu malutkich kryształków; mówimy, że te ciała mają strukturę polikrystaliczną. Wreszcie w przyrodzie występują ciała niekrystaliczne takie jak np. szkło, w których uporządkowanie atomowe nie rozciąga się na duże odległości.
W dalszej części rozdziału zajmiemy się ciałami krystalicznymi. Ich klasyfikację prowadzi się zarówno według ich struktury krystalicznej (geometrycznej) jak i według dominującego rodzaju wiązania.
37.1 Rodzaje kryształów (rodzaje wiązań)
Ze względu na typy wiązań kryształy dzielimy na:
- Kryształy cząsteczkowe (molekularne)
- Kryształy o wiązaniach wodorowych
- Kryształy jonowe
- Kryształy atomowe (kowalentne)
- Kryształy metaliczne
Kryształy cząsteczkowe
Kryształy cząsteczkowe (molekularne) składają się ze stabilnych cząsteczek,
oddziaływujących ze sobą słabymi siłami wiążącymi tzw. siłami
van der Waalsa ![]() ,
takimi jakie występują pomiędzy cząsteczkami w fazie gazowej.
,
takimi jakie występują pomiędzy cząsteczkami w fazie gazowej.
Oddziaływanie to jest związane z przesunięciami ładunków w cząsteczkach. Cząsteczki zachowują się jak dipole elektryczne i oddziaływanie pomiędzy dipolami stanowi siłę wiążącą kryształ.
Ciała cząsteczkowe tworzą między innymi w stanie stałym gazy szlachetne i zwykłe gazy,
takie jak tlen, azot, wodór. Energia wiązania jest słaba, rzędu 10−2
eV tj. 10−21 J. Przypomnijmy sobie, że energia cieplna cząsteczki
w temperaturze pokojowej tj. około 300 K wynosi ![]() .
.
Ta energia ruchu termicznego jest odpowiedzialna za rozrywanie wiązań.
Widać więc, z porównania jej z energią wiązania, dlaczego
zestalenie kryształów cząsteczkowych zachodzi dopiero w bardzo
niskich temperaturach. Na przykład temperatura zestalania wodoru wynosi 14 K (tj. −259 °C).
Kryształy cząsteczkowe, ze względu na brak elektronów swobodnych są na ogół bardzo złymi przewodnikami ciepła i elektryczności.
Kryształy o wiązaniach wodorowych
W pewnych warunkach atomy wodoru mogą tworzyć silne wiązania z atomami pierwiastków elektroujemnych takich jak np. tlen czy azot. Te wiązania zwane wodorowymi odgrywają ważną rolę min. w kryształach ferroelektrycznych i w cząsteczkach kwasu DNA (dezoksyrybonukleinowego).
Kryształy jonowe
Kryształy jonowe składają się z trójwymiarowego naprzemiennego ułożenia dodatnich i ujemnych jonów. Jony, ułożone jak gęsto upakowane kulki, przyciągają się siłami kulombowskimi. Przykładem takiego kryształu jest pokazany na rysunku 37.1 kryształ chlorku sodu (NaCl).
Kryształy jonowe, ze względu na brak swobodnych elektronów są złymi przewodnikami elektryczności i ciepła. Ponieważ siły kulombowskie wiążące kryształy jonowe są duże więc kryształy te są zazwyczaj twarde i mają wysoką temperaturę topnienia.
Kryształy atomowe (kowalentne)
Kryształy kowalentne składają się z atomów połączonych ze sobą
parami wspólnych elektronów walencyjnych ![]() tj. elektronów z najbardziej zewnętrznej powłoki. Chmura wspólnych
elektronów skupiona jest pomiędzy parą atomów więc wiązania te mają
kierunek i wyznaczają ułożenie atomów w strukturze
krystalicznej. Przykładami kryształów kowalentnych są diament, german, krzem.
tj. elektronów z najbardziej zewnętrznej powłoki. Chmura wspólnych
elektronów skupiona jest pomiędzy parą atomów więc wiązania te mają
kierunek i wyznaczają ułożenie atomów w strukturze
krystalicznej. Przykładami kryształów kowalentnych są diament, german, krzem.
Kryształy kowalentne są twarde i posiadają wysoką temperaturę topnienia. Brak elektronów
swobodnych powoduje, że ciała atomowe nie są dobrymi przewodnikami
elektryczności i ciepła. Czasami jednak, jak w przypadku wymienionych
Ge i Si są one półprzewodnikami ![]() .
.
Ciała metaliczne
Wiązanie metaliczne można sobie wyobrazić jako graniczny przypadek wiązania kowalentnego, w którym elektrony walencyjne są wspólne dla wszystkich jonów w krysztale, a nie tylko dla sąsiednich jonów.
Wynika to z tego, że w atomach, z których jest zbudowany kryształ metaliczny, elektrony na zewnętrznych powłokach są słabo związane i mogą zostać uwolnione z tych atomów kosztem bardzo małej energii. Te swobodne elektrony poruszają się w całym krysztale; są więc wspólne dla wszystkich jonów. Mówimy, że tworzą one gaz elektronowy wypełniający przestrzeń pomiędzy dodatnimi jonami.
Gaz elektronowy działa na każdy jon siłą przyciągania większą od odpychania pozostałych jonów w wyniku czego tworzy się wiązanie. Ponieważ istnieje wiele nie obsadzonych stanów elektronowych (na zewnętrznych powłokach są wolne miejsca) to elektrony mogą poruszać się swobodnie w krysztale od atomu do atomu. W konsekwencji kryształy metaliczne są doskonałymi przewodnikami elektryczności i ciepła. Przykładem kryształów metalicznych są kryształy tworzone przez metale alkaliczne.
W podsumowaniu należy zaznaczyć, że istnieją kryształy, w których wiązania muszą być interpretowane jako mieszanina opisanych powyżej głównych typów wiązań. Typ wiązania w poszczególnych kryształach wyznacza się doświadczalnie min. przez badanie dyfrakcji promieni X.
Przejdziemy teraz do omówienia podstawowych własności materiałów. Zaczniemy od omówienia energii,
jakie mogą posiadać elektrony znajdujące się w ciałach stałych.
Struktura stanów energetycznych elektronów w ciałach stałych czy może być dobrze opisana w ramach tzw.
pasmowej struktury ciał stałych ![]() .
.


 Lasery
Lasery