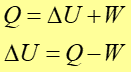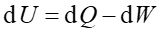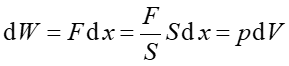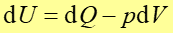15.4 Pierwsza zasada termodynamiki
W mechanice rozważaliśmy zmiany energii mechanicznej układu będące wynikiem pracy wykonanej przez siły zewnętrzne. W przemianach termodynamicznych możliwy jest inny (nie mechaniczny) sposób przekazywania energii. Gdy dwa układy o różnych temperaturach zetkniemy ze sobą to ciepło Q przepływa z ciała cieplejszego do chłodniejszego.
Zgodnie z zasadą zachowania energii
|
Prawo, zasada, twierdzenie Ciepło pobrane przez układ jest równe wzrostowi energii wewnętrznej układu plus pracy wykonanej przez układ nad otoczeniem zewnętrznym. |
|
(15.22) |
To jest sformułowanie pierwszej zasady termodynamiki. W tym zapisie mamy rozdzieloną energię ciała na część makroskopową (energię mechaniczną) i mikroskopową (energię wewnętrzną). Zasada ta działa również w "drugą stronę" to znaczy, gdy nad układem zostanie wykonana praca to układ może oddawać ciepło. To równanie często piszemy w postać różniczkowej
|
(15.23) |
Widzimy, że zmiana energii wewnętrznej związana jest z ciepłem pobieranym (dQ > 0) lub oddawanym (dQ < 0) przez układ oraz z pracą wykonaną przez układ (dW > 0) lub nad układem (dW < 0).
Jeżeli rozpatrzymy gaz działający siłą F na tłok o powierzchni S, jak na rysunku 15.3, to praca wykonana przez gaz wynosi
|
(15.24) |
|
(15.25) |
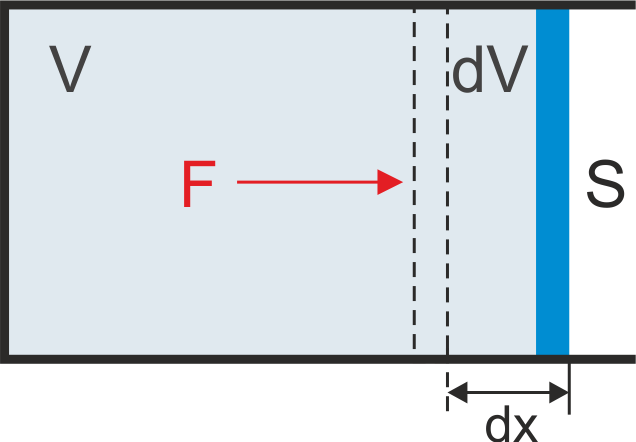
Rys. 15.3. Gaz wykonuje pracę przesuwając tłok na odcinku dx
Pamiętamy, że w mechanice praca sił zachowawczych wykonana nad punktem materialnym poruszającym się między dwoma punktami zależała tylko od tych punktów, a nie od łączącej je drogi. W termodynamice stwierdzamy, że
|
Prawo, zasada, twierdzenie Zmiana energii wewnętrznej układu, przy przejściu pomiędzy dwoma stanami, zależy wyłącznie od tego jaki jest stan początkowy i końcowy przejścia. |
Oznacza to, że chociaż dQ i dW z osobna
zależą od drogi przejścia to dU ma określoną wartość niezależną
od sposobu przejścia układu do stanu końcowego. Taką wielkość fizyczną
(funkcję tego typu), która charakteryzuje stan układu, i której wartości
nie zależą od sposobu w jaki układ został do danego stanu doprowadzony
nazywamy funkcją stanu ![]() .
.
|
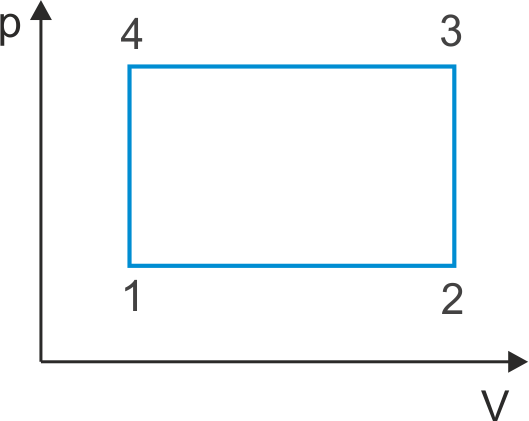
Ćwiczenie Teraz korzystając z pierwszej zasady termodynamiki określ jaki znak mają zmiana energii wewnętrznej ΔU oraz praca W dla cyklu przemian 1→2→3→4→1 pokazanych na rysunku poniżej (wykres p(V)). Wyniki zapisz w tabeli pokazanej poniżej. Zauważ, że obliczanie pracy W = pΔV sprowadza się do obliczenia pola pod wykresem p(V). Przyjmując wartości V1 = V4 = 1 dm3, V2 = V3 = 2 dm3, p1 = p2 = 1 atm. oraz p3 = p4 = 1.01 atm. oblicz pracę wykonaną w cyklu zamkniętym 1→2→3→4→1. Sprawdź obliczenia i wynik. |
| Przemiana | znak (+/0/−) |
|---|---|
| W ΔU | |
| 1→2 | |
| 2→3 | |
| 3→4 | |
| 4→1 | |
| 1→2→3→4→1 |


 Ekwipartycja energii
Ekwipartycja energii