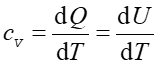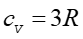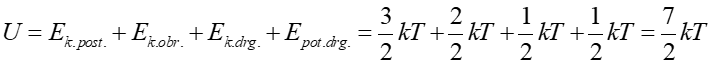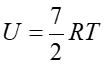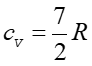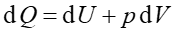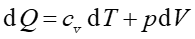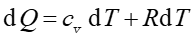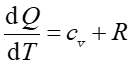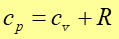15.5 Ciepło właściwe
|
Definicja Ciepło właściwe substancji definiujemy jako dQ/dT czyli ilość ciepła, którą trzeba dostarczyć do jednostki masy, żeby spowodować jednostkową zmianę jej temperatury. |
Gdy masę wyrażamy w kilogramach to mówimy o cieple
właściwym wagowym ![]() ,
a gdy wyrażamy ją w molach to mamy do czynienia z molowym
ciepłem właściwym
,
a gdy wyrażamy ją w molach to mamy do czynienia z molowym
ciepłem właściwym ![]() .
.
Ciepło właściwe przy stałej objętości
Ciepło właściwe jednego mola gazu utrzymywanego w stałej objętości oznaczamy cv. Ponieważ dV = 0 więc zgodnie z pierwszą zasadą termodynamiki dU = dQ, a stąd
|
(15.26) |
Dla gazu jednoatomowego (dla jednego mola) mamy na podstawie równania (15.19)
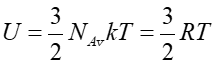 . Zatem
. Zatem
|
(15.27) |
Dla jednego mola gazu dwuatomowego na podstawie równania (15.21)
|
(15.28) |
a dla jednego mola cząsteczek wieloatomowych z równania (15.20)
|
(15.29) |
Jak wynika z powyższych obliczeń mechanika klasyczna przewiduje ciepło właściwe niezależne od temperatury. Tymczasem badania pokazują, że jest to prawdziwe tylko dla gazów jednoatomowych. Dla pozostałych cv rośnie z temperaturą.
Przykład takiej zależności jest pokazany na rysunku 15.4 gdzie przedstawiono ciepło
właściwe cv dla wodoru (cząsteczka dwuatomowa H2)
w funkcji temperatury (w skali logarytmicznej). Zauważmy, że w
temperaturach niższych od 100 K, 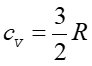 co wskazuje, że w tak niskich temperaturach cząsteczka porusza się tylko
ruchem postępowym i nie wiruje. Rotacja staje się możliwa dopiero w
temperaturach powyżej 100 K; i dopiero wtedy
co wskazuje, że w tak niskich temperaturach cząsteczka porusza się tylko
ruchem postępowym i nie wiruje. Rotacja staje się możliwa dopiero w
temperaturach powyżej 100 K; i dopiero wtedy 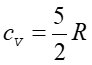 .
Ale w temperaturach powyżej 2000 K ciepło właściwe cv
rośnie do wartości
.
Ale w temperaturach powyżej 2000 K ciepło właściwe cv
rośnie do wartości 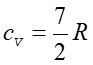 co oznacza, że przybyły jeszcze dwa stopnie swobody. Ten wynik doświadczalny
wiążemy z drganiami atomów w cząsteczkach. W tak wysokich temperaturach
cząsteczka przestaje się zachowywać jak ciało sztywne i zderzenia między
cząsteczkami powodują, że dwa atomy wodoru (w cząsteczce) będą drgały.
co oznacza, że przybyły jeszcze dwa stopnie swobody. Ten wynik doświadczalny
wiążemy z drganiami atomów w cząsteczkach. W tak wysokich temperaturach
cząsteczka przestaje się zachowywać jak ciało sztywne i zderzenia między
cząsteczkami powodują, że dwa atomy wodoru (w cząsteczce) będą drgały.
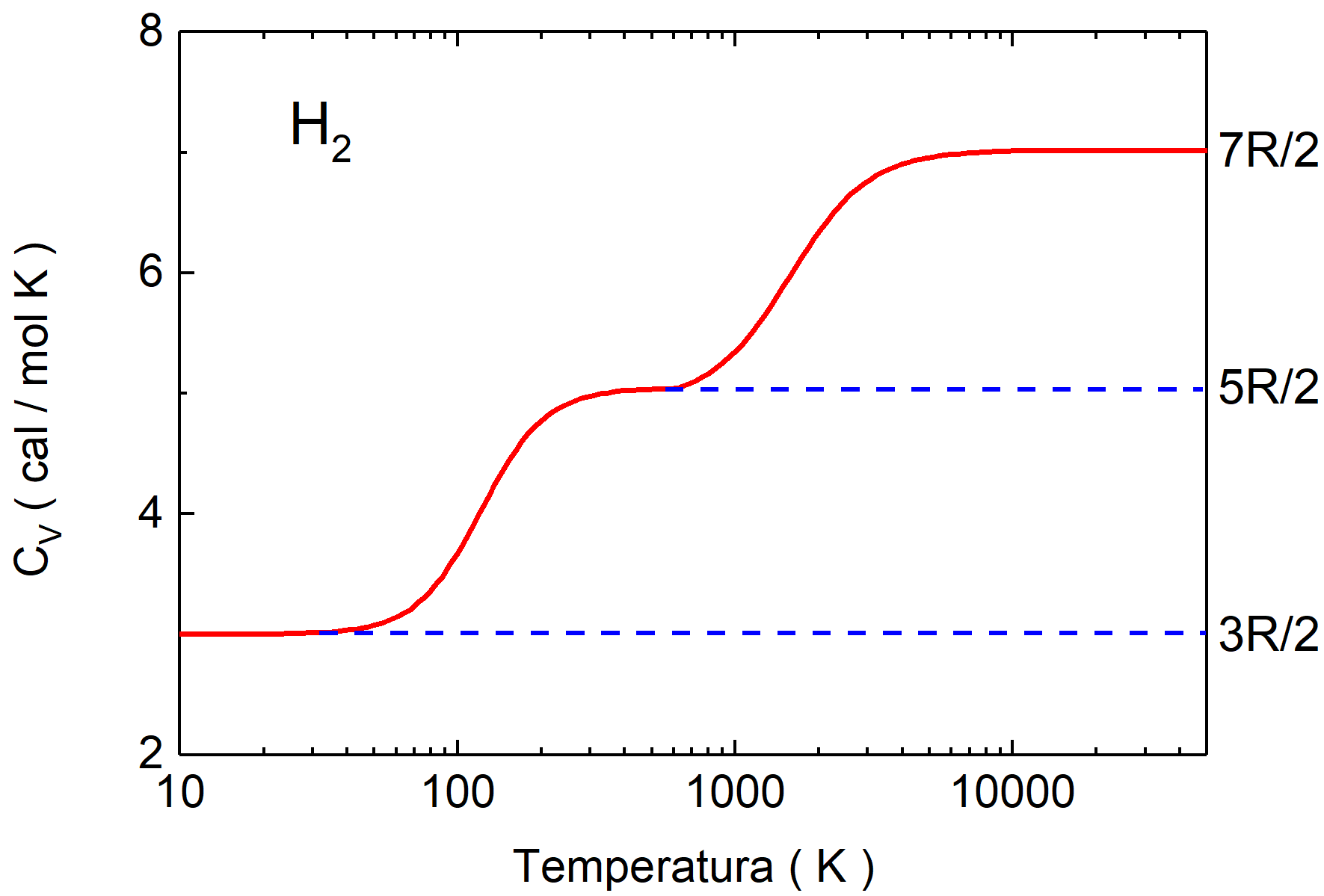
Rys. 15.4. Zależność molowego ciepła właściwego wodoru od temperatury Gaz wykonuje pracę przesuwając tłok na odcinku dx
Wytłumaczenie tych zjawisk nie jest możliwe na gruncie mechaniki klasycznej. Dopiero mechanika kwantowa daje wyjaśnienie tych zmian ciepła właściwego. Na jej gruncie można pokazać, że do wzbudzenia rotacji potrzeba pewnej minimalnej energii. Podobnie jest dla ruchu drgającego, który może być wywołany dopiero dla dostatecznie wysokiej energii Więcej o ...
Zatem w wysokich temperaturach oprócz energii kinetycznej ruchu postępowego i obrotowego istnieje jeszcze energia kinetyczna i potencjalna drgań. Zatem średnia energia wewnętrzna na cząsteczkę wodoru wynosi
|
(15.30) |
|
(15.31) |
Stąd otrzymujemy molowe ciepło właściwe przy stałej objętości
|
(15.32) |
Ciepło właściwe przy stałym ciśnieniu
Zgodnie z pierwszą zasadą termodynamiki
|
(15.33) |
a na podstawie równania (15.26)
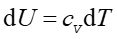 więc
więc
|
(15.34) |
Z równania stanu gazu doskonałego (15.15)
wynika, że dla jednego mola gazu 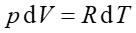 więc
więc
|
(15.35) |
Dzieląc stronami przez dT otrzymujemy
|
(15.36) |
a to z definicji jest równe ciepłu właściwemu przy stałym ciśnieniu cp
|
(15.37) |
Widzimy, że ciepło właściwe przy stałym ciśnieniu jest większe od ciepła właściwego przy stałej objętości cp > cv. Dzieje się tak dlatego, że w przemianie izobarycznej trzeba dostarczać ciepła nie tylko na zmianę energii wewnętrznej, związaną ze zmianą temperatury, ale i na wykonanie pracy związanej ze zmianą objętości podczas gdy w przemianie izochorycznej praca jest równa zeru.
|
Ćwiczenie Korzystając z powyższej zależności (15.37) i pamiętając, że średnia energia przypadająca na jeden stopień swobody wynosi |
| Typ gazu | cp | cvp | cp/cv |
|---|---|---|---|
| Jednoatomowy | |||
| Dwuatomowy + rotacja | |||
| Dwuatomowy + rotacja + drgania | |||
| Wieloatomowy + rotacja | |||
| Wieloatomowy + rotacja + drgania |


 Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki