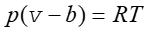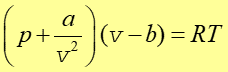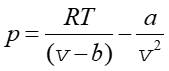16.3 Równanie stanu Van der Waalsa
Przypomnijmy, że równanie stanu gazu doskonałego
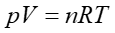 dobrze opisuje gazy rzeczywiste ale przy małych gęstościach.
Przy większych gęstościach nie można pominąć faktu, że cząstki
zajmują część objętości dostępnej dla gazu oraz że działają na
siebie siłami przyciągania lub odpychania w zależności od odległości
między nimi.
dobrze opisuje gazy rzeczywiste ale przy małych gęstościach.
Przy większych gęstościach nie można pominąć faktu, że cząstki
zajmują część objętości dostępnej dla gazu oraz że działają na
siebie siłami przyciągania lub odpychania w zależności od odległości
między nimi.
Van der Waals zmodyfikował równanie stanu gazu doskonałego, tak aby uwzględnić te czynniki.
Jeżeli cząstki posiadają skończoną objętość to rzeczywista objętość dostępna dla cząstek jest mniejsza od objętości naczynia. "Objętość swobodna" jest mniejsza od objętości naczynia o "objętość własną" cząsteczek b. Jeżeli oznaczymy przez v objętość przypadającą na jeden mol v = V/n to otrzymamy zmodyfikowane równanie stanu gazu
|
(16.8) |
Można również prosto uwzględnić efekt sił międzycząsteczkowych. W dowolnym miejscu w naczyniu siła przyciągania pomiędzy n cząsteczkami (na jednostkę objętości) z sąsiednimi n cząsteczkami (na jednostkę objętości) jest proporcjonalna do n2 czyli proporcjonalna do 1/v2. Siła przyciągająca wywołuje dodatkowe ciśnienie. Stąd otrzymujemy równanie Van der Waalsa
|
(16.9) |
Stałe a i b, różne dla różnych gazów, wyznaczamy doświadczalnie.
Na rysunku 16.3 porównano zachowanie się gazu doskonałego (a) z gazem Van der Waalsa (b). Skala obu rysunków jest jednakowa.
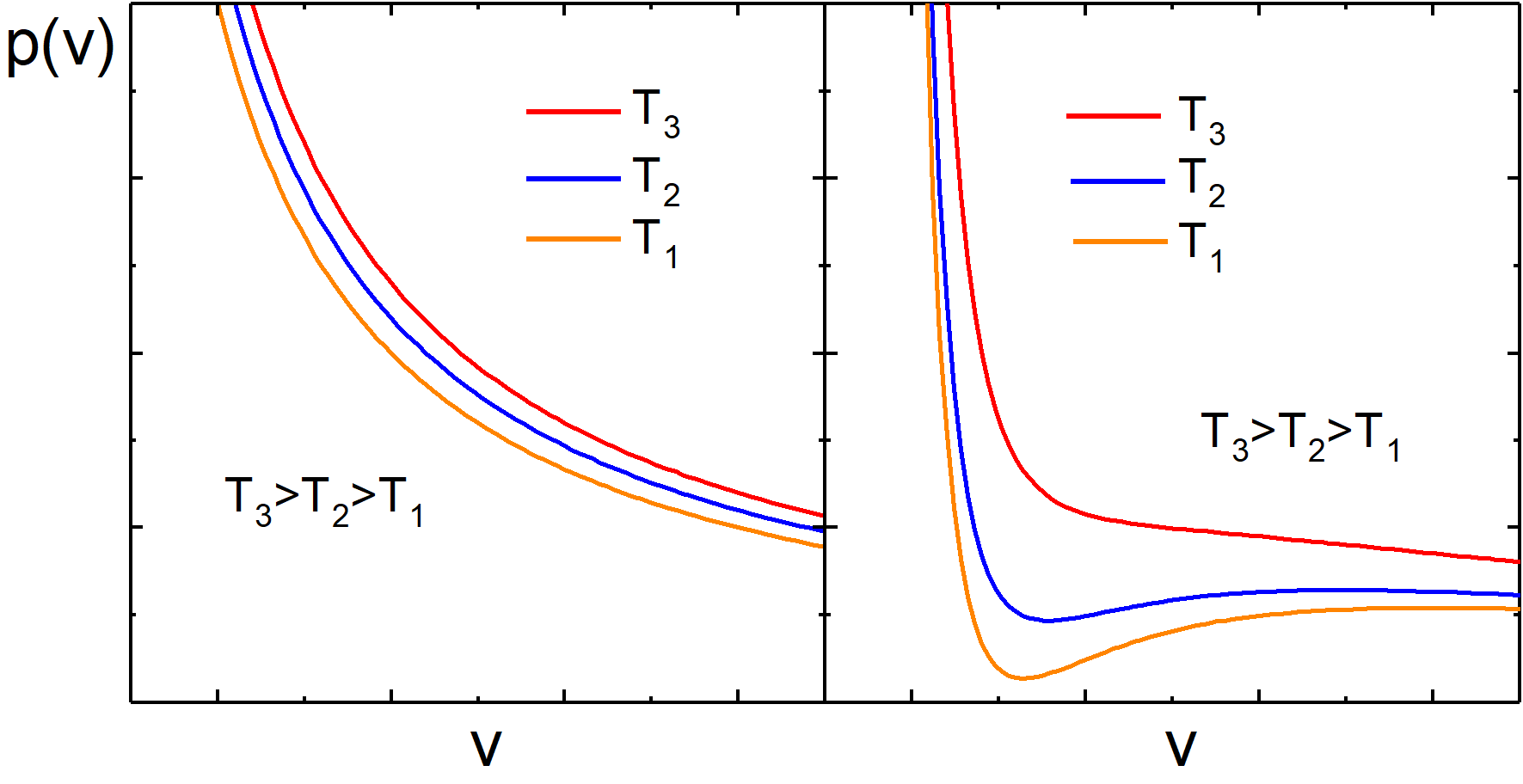
Rys. 16.3. Porównanie izoterm gazu doskonałego (a) z izotermami gazu Van der Waalsa
Izotermy gazu doskonałego są hiperbolami danymi równaniem pV = const. Natomiast dla gazu Van der Waalsa ciśnienie zmienia się zgodnie z zależnością
|
(16.10) |
Widzimy, że dla wysokich temperatur izotermy gazu Van
der Waalsa zbliżają się do izoterm dla gazu idealnego. Natomiast poniżej
pewnej temperatury, tak zwanej temperatury
krytycznej ![]() , obserwujemy
charakterystyczne minima i maksima w zależności p(v).
, obserwujemy
charakterystyczne minima i maksima w zależności p(v).
Temperatura krytyczna jest ważnym parametrem charakteryzującym dany gaz. Poniżej temperatury krytycznej gaz rzeczywisty może ulec skropleniu, a powyżej niej może występować wyłącznie w stanie gazowym.
Temperatury krytyczne większości gazów są niskie i dlatego nie jest łatwo je skroplić. Na przykład temperatura krytyczna dwutlenku węgla wynosi 304 K, ale wodoru już 33 K, a helu 5.3 K. Pionierami badań nad uzyskiwaniem niskich temperatur byli Karol Olszewski i Zygmunt Wróblewski, którzy w 1883 roku jako pierwsi dokonali skroplenia powietrza (azot, tlen).
Chociaż, równanie Van der Waalsa daje dobry opis jakościowy to bywa czasami zawodne przy opisie ilościowym. Jednak nie jest znana prosta formuła, która stosowałaby się do różnych gazów w różnych warunkach.


 Rozkład Maxwella prędkości cząsteczek
Rozkład Maxwella prędkości cząsteczek