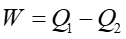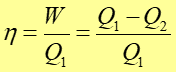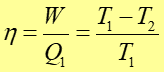16.4 Procesy odwracalne i nieodwracalne, cykl Carnota
Procesy odwracalne i nieodwracalne
Rozpatrzmy dwa przypadki izotermicznego sprężania gazu.
W pierwszym, tłok przesuwamy bardzo szybko i czekamy aż ustali się równowaga z otoczeniem. W czasie takiego procesu ciśnienie i temperatura gazu nie są dobrze określone bo nie są jednakowe w całej objętości.
W drugim tłok przesuwamy bardzo powoli tak, że ciśnienie i temperatura gazu są w każdej chwili dobrze określone. Ponieważ zmiana jest niewielka to gaz szybko osiąga nowy stan równowagi. Możemy złożyć cały proces z ciągu takich małych przesunięć tłoka i wtedy podczas całego procesu gaz jest bardzo blisko równowagi. Jeżeli będziemy zmniejszać nasze zmiany to w granicy dojdziemy do procesu idealnego, w którym wszystkie stany pośrednie (pomiędzy początkowym i końcowym) są stanami równowagi.
Pierwszy proces nazywamy procesem nieodwracalnym
![]() , a proces drugi procesem
odwracalnym
, a proces drugi procesem
odwracalnym ![]() .
.
|
Definicja Proces nazywamy odwracalnym gdy za pomocą bardzo małej (różniczkowej) zmiany otoczenia można wywołać proces odwrotny do niego tzn. przebiegający po tej samej drodze w przeciwnym kierunku. |
Cykl Carnota
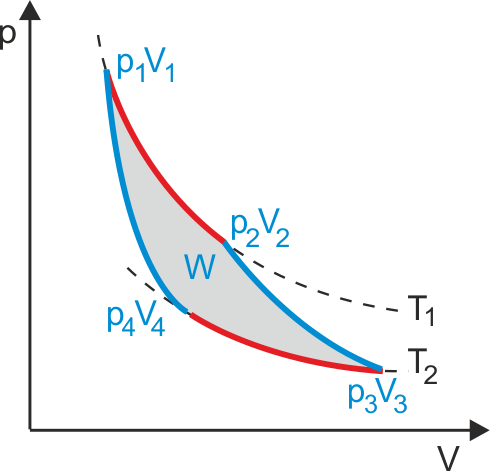
Przykładem cyklu odwracalnego jest cykl Carnota. Jest to bardzo ważny cykl odwracalny ponieważ wyznacza granicę naszych możliwości zamiany ciepła na pracę. Cykl Carnota, pokazany na rysunku-animacji 16.4 przebiega czterostopniowo:
Gaz znajduje się w stanie równowagi p1, V1, T1. Cylinder stawiamy na zbiorniku ciepła (T1) i pozwalamy, żeby gaz rozprężył się izotermicznie do stanu p2, V2, T1. W tym procesie gaz pobiera ciepło Q1 i jego kosztem wykonuje pracę podnosząc tłok.
Cylinder stawiamy na izolującej podstawce i pozwalamy na dalsze rozprężanie (adiabatyczne) gazu do stanu p3, V3, T2. Gaz wykonuje pracę podnosząc tłok kosztem własnej energii i jego temperatura spada do T2.
Cylinder stawiamy na zimniejszym zbiorniku (T2) i sprężamy gaz izotermicznie do stanu p4, V4, T2. Pracę wykonuje siła zewnętrzna pchająca tłok, a z gazu do zbiornika przechodzi ciepło Q2.
Cylinder stawiamy na izolującej podstawce i sprężamy adiabatycznie do stanu początkowego p1, V1, T1. Siły zewnętrzne wykonują pracę i temperatura gazu podnosi się do T1.
Praca wykonywana przez gaz lub siłę zewnętrzną jest równa każdorazowo polu pod wykresem p(V) odpowiadającym danej przemianie (rysunek-animacja 16.4) . Stąd wypadkowa praca W wykonana przez układ w czasie pełnego cyklu jest opisana przez powierzchnię zawartą wewnątrz zamkniętej krzywej opisującej cały cykl.
Kliknij w dowolnym miejscu na rysunku żeby uruchomić animację. Ponowne kliknięcie oznacza powrót do początku.
Wypadkowa ilość ciepła pobrana przez układ podczas jednego cyklu wynosi Q1 − Q2. Natomiast wypadkowa zmiana energii wewnętrznej wynosi zero bo stan końcowy pokrywa się z początkowym, więc na podstawie pierwszej zasady termodynamiki otrzymujemy
|
(16.11) |
Schematycznie jest to przedstawione na rysunku 16.5. poniżej.
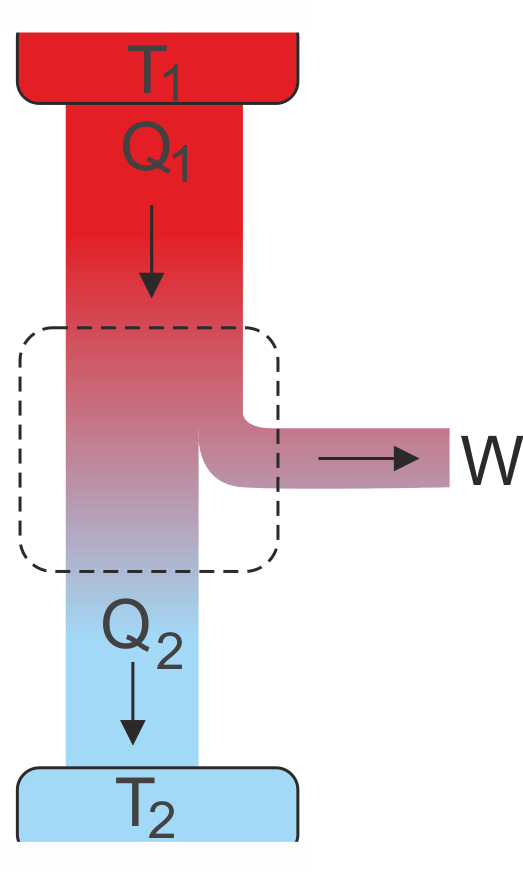
Rys. 16.5. Część pobranego ciepła Q1 jest w silniku zamieniana na pracę W, a część oddawana jako ciepło Q2.
Widzimy, że pewna ilość ciepła została zamieniona na pracę. Możemy
powtarzać ten cykl uzyskując potrzebną ilość pracy. Takie urządzenie
nazywamy silnikiem cieplnym ![]() .
Sprawność η silnika cieplnego definiujemy jako
.
Sprawność η silnika cieplnego definiujemy jako
|
(16.12) |
Korzystając z równania stanu gazu doskonałego i z pierwszej zasady termodynamiki można pokazać Więcej o ... , że sprawność silnika Carnota (dla gazu doskonałego) wynosi
|
(16.13) |
Cykl Carnota można prowadzić w kierunku przeciwnym i wtedy urządzenie działa jako maszyna chłodząca.
|
Ćwiczenie Spróbuj teraz, korzystając z powyższego wzoru obliczyć maksymalną sprawność maszyny parowej, która pobiera z kotła parę o temperaturze 227 °C, a oddaje do otoczenia parę o temperaturze 127 °C. Porównaj tę sprawność ze sprawnością zwykłego silnika samochodowego (około 25%). Jaki wpływ na sprawność miałoby podniesienie temperatury pary w kotle? Sprawdź obliczenia i wynik. |


 Równanie stanu Van der Waalsa
Równanie stanu Van der Waalsa