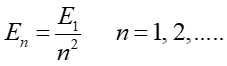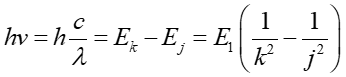33.4 Stany energetyczne i widmo atomowe wodoru
Teoria Bohra przewiduje, że całkowita energia elektronu (i w konsekwencji energia atomu) jest wielkością skwantowaną. Dozwolone wartości energii elektronu są dane wzorem
|
(33.12) |
Na podstawie tych wartości możemy, korzystając z zależności (33.1), obliczyć energie kwantów promieniowania emitowanych (lub absorbowanych) przy przejściu między orbitami
|
(33.13) |
gdzie j, k są liczbami kwantowymi opisującymi niższy i wyższy stan stacjonarny, v jest częstotliwością promieniowania, λ długością fali , a c prędkością światła.
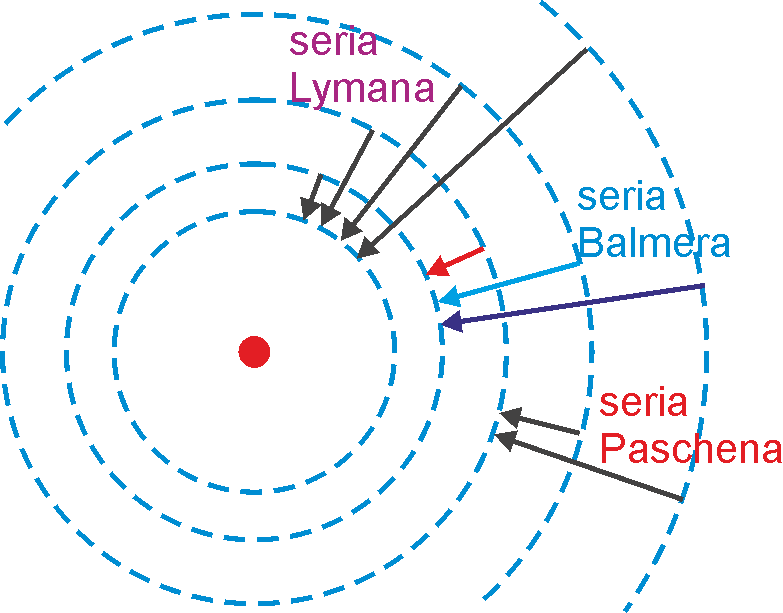
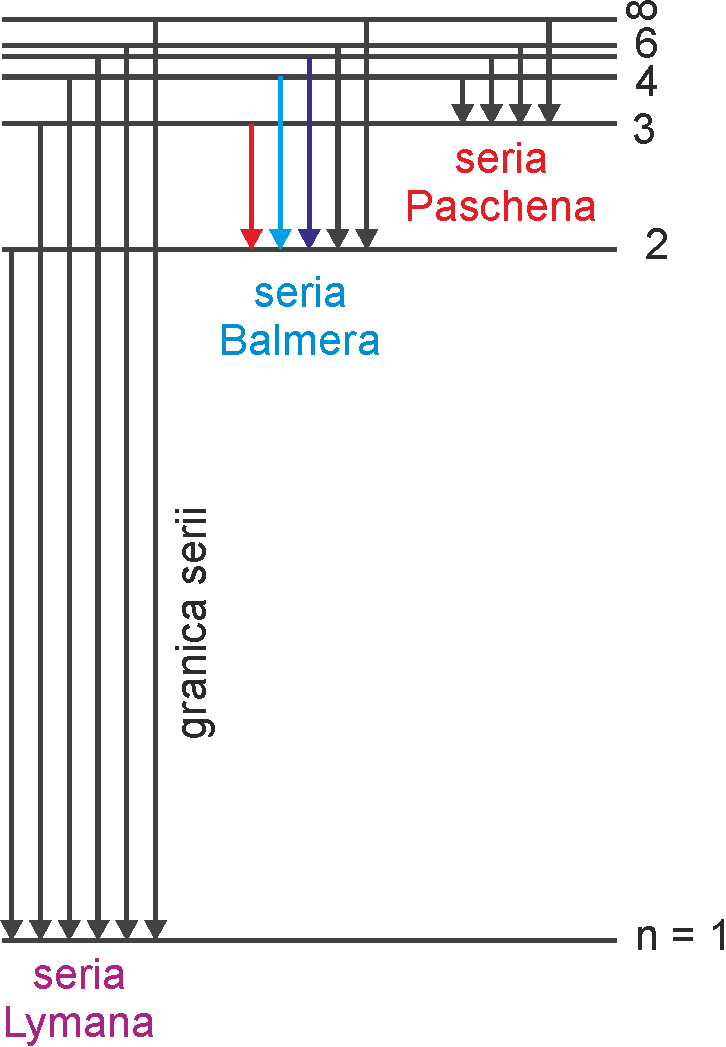
Na rysunku 33.4a poniżej zaznaczone są symbolicznie (strzałkami) przeskoki między różnymi orbitami, a na rysunku 33.4b energie emitowanych kwantów promieniowania przy przeskokach elektronów pomiędzy odpowiadającymi im stanami stacjonarnymi. Długość każdej ze strzałek odpowiada różnicy energii między dwoma stanami stacjonarnymi czyli równa jest energii hv wypromieniowanego kwantu.
(Na rysunku 33.4a nie są zachowane proporcje pomiędzy promieniami orbit, które zmieniają się zgodnie z relacją rn = r1n2.)
|
|
|
Rys. 33.4. Przeskoki między
orbitami (a) i schemat poziomów energetycznych w atomie wodoru (b).
Zaznaczone są trzy z istniejących serii widmowych
Przejścia pomiędzy stanami stacjonarnymi i odpowiadające im linie widmowe tworzą serie widmowe. Dana seria obejmuje promieniowanie emitowane przy przejściu elektronu z poziomów wyższych na dany np. seria Balmera obejmuje przejścia ze stanów o n > 2 do stanu o n = 2.
Zauważmy ponadto, że tylko przejściom elektronu na drugą orbitę (seria Balmera) towarzyszy emisja promieniowania z zakresu widzialnego. Seria Lymana obejmuje promieniowanie w zakresie nadfioletu, a seria Paschena w podczerwieni.
|
Ćwiczenie Wiedząc, że energia stanu podstawowego E1 = −13.6 eV wykaż, że seria widmowa Balmera przypada na zakres widzialny światła? Sprawdź obliczenia i wynik. |
Na gruncie kwantowego modelu Bohra budowy atomu można łatwo zrozumieć własności widm emisyjnych i absorpcyjnych atomów jednoelektronowych. Jednak ten model nie wyjaśniał fundamentalnego faktu, dlaczego pojęć mechaniki klasycznej nie można stosować w świecie atomów (cząstek elementarnych).
Model Bohra został zastąpiony nowym udoskonalonym modelem budowy atomu, w którym położenie elektronu w danej chwili czasu nie jest określone dokładnie lecz z pewnym prawdopodobieństwem, a sam elektron traktowany jest nie jak cząstka ale jako fala materii.


 Model Bohra atomu wodoru
Model Bohra atomu wodoru