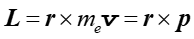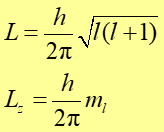W poprzednim module mówiliśmy o zastosowaniu mechaniki kwantowej do opisu falowych własności materii w tym do opisu atomu wodoru. Między innymi pokazaliśmy, że ta teoria przewiduje, że całkowita energia elektronu w atomie jednoelektronowym jest wielkością skwantowaną.
Na tej podstawie można wnioskować z kolei, że w atomie wieloelektronowym całkowita energia każdego z elektronów również jest skwantowana i w konsekwencji skwantowana też jest energia całego atomu.
Pokażemy teraz w jaki sposób mechanika kwantowa pozwala zrozumieć strukturę atomów wieloelektronowych wyjaśniając między innymi dlaczego w atomie znajdującym się w stanie podstawowym wszystkie elektrony nie są związane na najbardziej wewnętrznej powłoce (orbicie). Fizyka klasyczna nie wyjaśnia tego problemu; dopiero mechanika kwantowa przyniosła podstawy teoretyczne, na gruncie których można przewidzieć własności pierwiastków.
36.1 Orbitalny moment pędu i spin elektronu
Rozwiązując równanie Schrödingera dla atomu wodoru stwierdziliśmy, że funkcja falowa elektronu zależy od trzech liczb kwantowych n, l, ml, przy czym stwierdziliśmy, że główna liczba kwantową n jest związana z kwantowaniem energii całkowitej elektronu w atomie wodoru.
Okazuje się, że liczby kwantowe l, ml opisują z kolei kwantowanie przestrzenne momentu pędu elektronu.
Orbitalny moment pędu
Zgodnie z zasadami mechaniki klasycznej moment pędu elektronu krążącego wokół jądra w odległości r jest dany wyrażeniem
|
(36.1) |
Jednak z zasady nieoznaczoności (paragraf 35.2) wynika, że nie można jednocześnie w dokładny sposób wyznaczyć położenia i pędu elektronu więc nie można też dokładnie wyznaczyć momentu pędu.
Okazuje się, że dla elektronu krążącego wokół jądra można dokładnie wyznaczyć jego wartość (długość wektora L) oraz rzut wektora L na pewną wyróżnioną oś w przestrzeni (na przykład oś z) to znaczy wartość jednej jego składowej Lz (rysunek 36.1). Pozostałe składowe Lx i Ly mają wartości nieokreślone.
Wartości L oraz Lz są skwantowane
|
(36.2) |
gdzie l = 0, 1, 2, ...; ml = 0, ±1, ±2, ±3, ...., ±l.
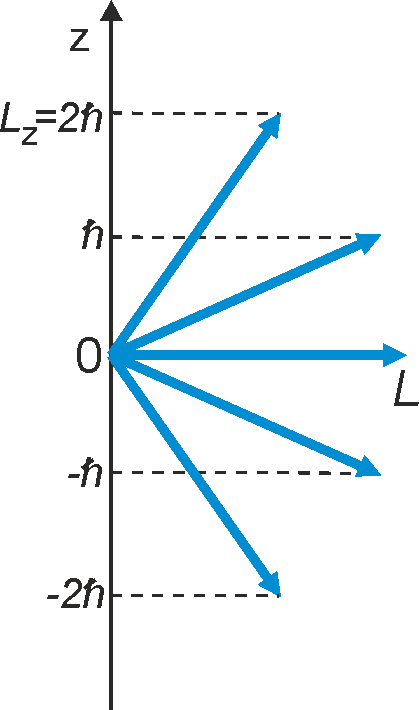
Rys. 36.1. Kwantowanie orbitalnego momentu pędu L (l = 2).
Podsumowując
|
Prawo, zasada, twierdzenie | Wartość orbitalnego momentu pędu elektronu w atomie i jego rzut na oś z przyjmują ściśle określone wartości zależne od liczb kwantowych l i ml. |
Spin elektronu
W 1922 roku Otto Stern i Walter Gerlach przygotowali eksperyment mający na celu pomiar momentów magnetycznych atomów srebra. W tym doświadczeniu, pokazanym na rysunku 36.2, wiązka elektrycznie obojętnych atomów srebra jest przepuszczana między biegunami magnesu wytwarzającego niejednorodne pole magnetyczne.
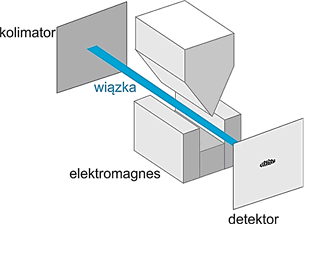
Rys. 36.2. Doświadczenie Sterna-Gerlacha
W wyniku oddziaływania pola magnetycznego na wiązkę rozdziela się ona na dwie (rysunek 36.3).
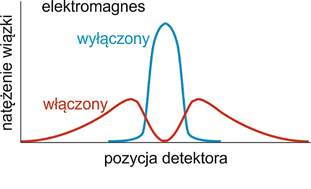
Rys. 36.3. Doświadczenie Sterna-Gerlacha
Ten rezultat można wyjaśnić jedynie na gruncie mechaniki kwantowej.
Wraz z badaniami widm optycznych atomów wodoru i metali alkalicznych stanowi on dowód,
na to, że wszystkie elektrony mają, oprócz orbitalnego, również wewnętrzny moment pędu, który został nazwany
spinowym momentem pędu (spinem) ![]() .
Spin jest charakterystyczną, wewnętrzną cechą, elektronu, którą można sobie wyobrazić jako wirowanie wokół pewnej osi obrotu
(analogicznie jak Ziemia obiegająca Słońce i obracająca się wokół swej osi).
.
Spin jest charakterystyczną, wewnętrzną cechą, elektronu, którą można sobie wyobrazić jako wirowanie wokół pewnej osi obrotu
(analogicznie jak Ziemia obiegająca Słońce i obracająca się wokół swej osi).
Okazuje się ponadto, że spin jest skwantowany przestrzennie, i że dla danego stanu
orbitalnego są możliwe dwa kierunki spinu czyli, że rzut wektora spinu na oś z może przyjmować tylko dwie wartości co
określa spinowa liczba kwantowa s ![]() ,
która może przyjmować dwie wartości s = ± ½.
,
która może przyjmować dwie wartości s = ± ½.
Moment pędu atomu jest sumą momentów pędów orbitalnych i spinów wszystkich elektronów w atomie i jest też skwantowany przestrzennie.


 Test
Test