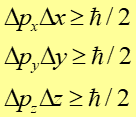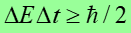35.2 Zasada nieoznaczoności
Zauważmy, że jedną z konsekwencji falowo-cząsteczkowej natury materii jest to, że jedyne czego możemy dowiedzieć się o ruchu elektronów to prawdopodobieństwo znalezienia ich w przestrzeni. Powstaje pytanie czy musimy zadowolić się taką informacją czy też jest możliwy pomiar, który da nam odpowiedź na przykład na temat ewentualnych orbit po których poruszają się elektrony. Czy możemy "dokładnie" opisać ruch elektronu tzn. równocześnie określić jego położenie i prędkość?
Negatywna odpowiedź na to pytanie jest zawarta w zasadzie nieoznaczoności Heisenberga. Pierwsza część tej zasady dotyczy jednoczesnego pomiaru położenia i pędu.
|
Prawo, zasada, twierdzenie Głosi ona, że iloczyn nieokreśloności pędu cząstki i nieokreśloności jej położenia w danym kierunku jest zawsze większy od stałej Plancka. |
Ograniczenie to wyrażają nierówności
|
(35.2) |
Zauważmy, że im dokładniej mierzymy pęd, np. zmniejszamy Δpx, tym bardziej rośnie nieoznaczoność położenia Δx.
Druga część zasady nieoznaczoności dotyczy pomiaru energii i czasu potrzebnego na wykonanie tego pomiaru.
|
Prawo, zasada, twierdzenie | Jeżeli cząstka posiada energię E, to dokładność
jej wyznaczenia ΔE
zależy od czasu pomiaru Δt zgodnie z relacją
|
(35.3) |
Im dłużej cząstka jest w stanie o energii E tym dokładniej można ją wyznaczyć.
Na szczególne podkreślenie zasługuje fakt, że ograniczenie dokładności pomiarów nie ma nic wspólnego z wadami i niedokładnościami aparatury pomiarowej lecz jest wynikiem falowej natury cząstek. Tak małe obiekty jak cząstki elementarne czy atomy nie podlegają prawom mechaniki klasycznej, ale prawom mechaniki kwantowej.
Sama zasada stanowi podstawę stwierdzenia, że w fizyce kwantowej musimy posługiwać się pojęciem prawdopodobieństwa.
Zauważmy, na przykład, że określenie położenia przedmiotów opiera się na rejestrowaniu światła
odbitego przez te przedmioty. Po prostu widzimy gdzie są przedmioty. Światło
w „zderzeniu” z przedmiotami o dużej masie praktycznie nie zaburza
ich ruchu, ale całkiem inną sytuację mamy w przypadku elektronów.
Tutaj też moglibyśmy się spodziewać, że zobaczymy elektron gdy
odbije się od niego światło. Jednak elektron w zderzeniu z fotonem
doznaje odrzutu, który całkowicie zmienia jego ruch (przypomnij sobie
zjawisko Comptona). Tej zmiany ruchu elektronu nie można uniknąć ani
dokładnie ocenić. Gdyby więc elektron poruszał się po ściśle określonym
torze tzn. istniałyby orbity to byłyby one całkowicie niszczone przy
próbie pomiarów mających potwierdzić ich istnienie. Dlatego właśnie
mówimy o prawdopodobieństwie znalezienia elektronu a nie o określonych orbitach.
Więcej o ... zasadzie nieoznaczoności.
|
Ćwiczenie Przyjmijmy, że elektron w atomie wodoru porusza się z prędkością v = 106 m/s, którą mierzymy z dokładnością 1%. Z jaką najlepszą dokładnością możemy określić położenie tego elektronu. Wynik porównaj z promieniem orbity w modelu Bohra r1 = 5.3·10−11 m. Czy możemy w tych warunkach traktować elektron jak punkt materialny? Sprawdź obliczenia i wynik. |


 Funkcja falowa
Funkcja falowa